
 |
|
| top news research members message others |
![]() 研究紹介
研究紹介
・ 研究目的、概要
・ DOCKファミリー分子群による細胞骨格制御機構とその生理的意義
・ T細胞の分化、活性化を制御する抗原認識の分子基盤
![]() Publications
Publications
click >>>
研究目的、概要
細胞の高次機能は細胞骨格の再構築により巧妙に制御されています。このことは免疫系においても例外では
ありません。しかしながら、細胞骨格制御に関するこれまでの研究の多くは、繊維芽細胞など免疫系以外の細
胞を対象としたものであり、外来異物やアポトーシス細胞の貪食、リンパ球やマクロファージの遊走、抗原認識
など免疫系独自に進化したさまざまな細胞高次機能において細胞骨格の再構築が重要な意味を持つであろう
と考えられるにも関わらずその分子レベルでの理解は進んでいないのが現状です。多くの受容体やリガンドが
同定された今日、受容体刺激に伴うシグナルの’量’あるいは’質’が細胞骨格の再構築によりどのように制御
されているかを解明し、その機能発現との関連性を解析することは今後の免疫学の大きなテーマになるのでは
と考えられます。
私達の研究室では、各種受容体刺激から細胞骨格再構築に至るシグナル伝達を解明し、免疫系の発生,分化、
構築や機能発現における各シグナル伝達系の意義を明らかにすると共に、その理解に立脚して、自己免疫疾
患、移植片拒絶など現代医学が抱える難治性疾患の新しい治療法、予防法を開発することを目標として研究を
行っています。
DOCKファミリー分子を介したシグナル伝達機構の解明とその機能解析
DOCKファミリーは線虫から哺乳類に至るまで保存された分子群で、低分子量GTP結合蛋白質の上流で機能す
ることで細胞骨格の制御に関わっています。私達は、免疫系特異的に発現する分子としてDOCK2を
同定し、ノックアウトマウスを作製することで、この分子がケモカイン受容体の下流で機能し、Racの活性化を介
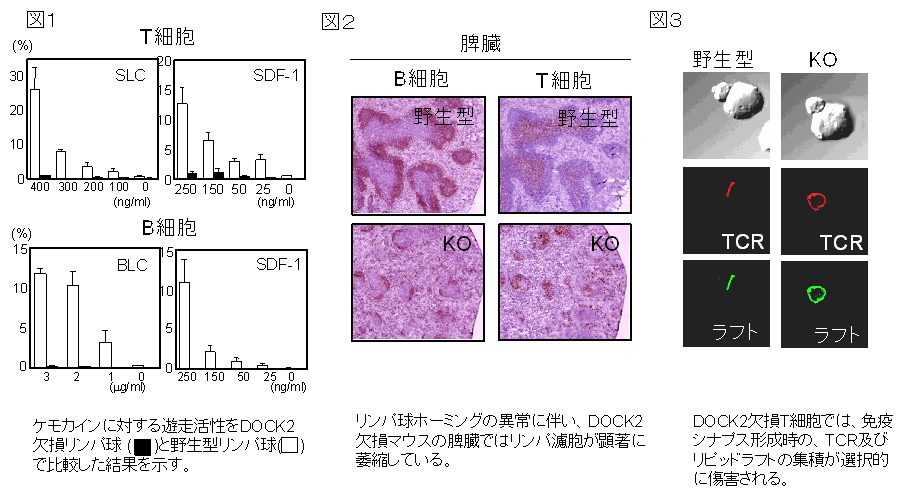
してリンパ球遊走を制御していることを世界に先駆けて明らかにしました。DOCK2欠損リンパ球はいずれのケモ
カイン刺激に対しても遊走活性を示さず (図1)、その結果2次リンパ組織においてリンパ濾胞の顕著な萎縮を
きたします (図2)。すなわち、DOCK2はリンパ球遊走に不可欠な分子です。
また、T細胞が抗原提示細胞と接触する際にその境界面に免疫シナプスと呼ばれる分子複合体が形成される
ことが報告され、近年その機序や意義が注目されています。私達は、DOCK2がT細胞受容体
(TCR) を介した
Rac活性化にも必須であり、免疫シナプス形成において、TCRおよびリピッドラフトの抗原提示細胞接触面への
集積を選択的に制御することを明らかにしました (図3)。DOCK2欠損T細胞における免疫シナプス形成の破綻
はT細胞増殖応答やT細胞レパートリー形成に影響を与えます。
移植片拒絶や自己免疫疾患の治療や予防は、現代医学がまさにその解決を迫られている重要な課題です。
その病態はリンパ球が浸潤し、活性化されることで惹起されることから、DOCK2はこれらの疾患を治療、予防
する上で格好の分子標的となると考えられます。このためには、DOCK2シグナル伝達を詳細に解析することが
不可欠です。私達はこれまでにDOCK2がELMO1という分子と会合することで、Rac活性化および細胞骨格を制
御することを明らかにしましたが、まだまだ解明しなければならないことが山積しています。
しかしその問題をひとつひとつ着実に解明し、DOCK2を介したシグナル伝達の全貌を明らかにすることで、移植
片拒絶や自己免疫疾患の新しい治療法や予防法の開発に資する基礎研究を展開していきたいと考えています。
T細胞の分化、活性化を制御する抗原認識の分子基盤
免疫応答は、T細胞受容体(TCR)が自己の主要組織適合抗原(MHC)に結合した抗原ペプチドを認識すること
により惹起されます。病原体の高度な多様性に対応すべく、TCR遺伝子は理論上1016を超える多様性を獲得す
ることが可能ですが、実際末梢で免疫応答に寄与するTCRは、免疫寛容およびMHC拘束という特徴を有し高度
に選択されています。これは、主に胸腺内T細胞分化過程において、TCR-MHC-自己抗原ペプチド相互作用の
結果もたらされる正と負の選択を介してなされます。
未熟胸腺細胞に’正’と’死’という相反する運命を課す分子機構は免疫学の大きなテーマであり、特に正の選
択における自己抗原ペプチドの関与に関しては多くの仮説が提唱されてきました。しかしながら、MHCには数千
の自己抗原ペプチドが結合しているため、分子レベルでの解析は困難でした。この問題を克服するために、私
達は1種類の抗原ペプチドのみを結合したMHCを発現する遺伝子改変マウスを作製することで、1)同じMHC/
自己抗原ペプチド複合体が胸腺での発現量に応じて正の選択のリガンドにも負の選択のリガンドにもなり得る
こと、および 2)正の選択においても特異的なTCR-ペプチド相互作用が関与し得るが、その際
3)TCRと直接
相互作用を持つアミノ酸残基の側鎖の大きさや荷電の有無が、選択されるT細胞レパートリーの多様性に影響
することを明らかにしました。また、4)この複合体の胸腺での発現量が著しく低い場合、不完全な負の選択に
より全身性の自己反応性が惹起され、その結果臓器特異的自己免疫疾患が起こることを明らかにし、MHCが
T細胞レパートリー形成を介して自己免疫疾患感受性を規定している可能性を提唱しました。
MHCが自己免疫疾患感受性を規定していることはよく知られていますが、そのメカニズムに関しては殆どわか
っておりません。私達はTCR-MHC/ペプチド複合体相互作用の理解を通してこの問題にアプローチしたいと考
えています。